باحث عربي يكشف لـ«العين الإخبارية» تفاصيل ابتكار مركب يسقط أشرس البكتيريا

في ظل تصاعد التحديات بسبب البكتيريا المقاومة للمضادات الحيوية، برزت بكتيريا "سيدوموناس أرجينوزا" كواحدة من أخطر التهديدات.
- باحثون يرصدون لحظة قتل الجهاز المناعي للبكتريا في الدم
وتهدد هذه البكتريا حياة المرضى، خاصة ذوي المناعة الضعيفة مثل مرضى السرطان. وفي هذا السياق، تمكن فريق بحثي مصري متميز من إحراز تقدم مهم بتطوير مركب مبتكر يعتمد على تقنية النانو، قادر على إسقاط هذه البكتيريا القوية، لفتح آفاق جديدة للعلاج.
"العين الإخبارية"، تتعرف أكثر على هذه الدراسة واكتشافاتها الثورية من خلال الحوار مع الدكتور غريب السيد الصياد، أستاذ مساعد في قسم تكنولوجيا التحاليل الطبية بكلية تكنولوجيا العلوم الصحية التطبيقية في جامعة بدر بالعاصمة المصرية القاهرة، والباحث الرئيسي بالدراسة.
ما أهمية هذه الدراسة التي أجراها فريقكم حول بكتيريا "سيدوموناس أرجينوزا"؟
بكتيريا "سيدوموناس أرجينوزا" تعتبر واحدة من أخطر العوامل الممرضة في بيئة المستشفيات، وقد صنفتها منظمة الصحة العالمية كأولوية حاسمة لتطوير مضادات حيوية جديدة، بسبب قدرتها على مقاومة معظم المضادات المستخدمة حاليا.
هذه البكتيريا تتميز بقدرتها العالية على التكيف وتكوين الأغشية الحيوية، مما يجعلها صعبة العلاج، خاصة عند مرضى السرطان الذين يعانون من نقص المناعة، ما يؤدي إلى ارتفاع معدلات الوفيات.
ما هو الابتكار الذي توصل إليه فريقكم في مواجهة هذه البكتيريا؟
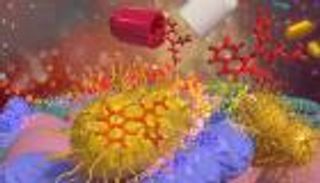
قمنا بتطوير مركب يستخدم تقنية النانو، يعتمد على جسيمات نانوية من الفضة وأكسيد النحاس، مرتبطة بالمضاد الحيوي "الكوليستين".
هذا المركب يظهر فعالية أعلى في مقاومة وقتل البكتيريا مقارنة بالمضاد الحيوي التقليدي.
كيف تم اختبار هذا المركب؟ وهل كانت النتائج مشجعة؟
أجرينا الاختبارات على بكتيريا "سيدوموناس أرجينوزا" المعزولة من مريض سرطان أطفال في المعهد القومي للأورام.
وجدنا أن المركب المطور استطاع قتل البكتيريا بفاعلية عالية في المختبر، متفوقا على الصيغ التقليدية للمضادات الحيوية الأخرى، ونتائجنا نُشرت في مجلة "بي إم سي ميكروبيولوجي".

ما الذي يجعل هذا المركب فعالا ضد البكتيريا المقاومة؟
المركب النانوي يخدع البكتيريا ويُفعّل آليات مثل إنتاج أنواع الأكسجين التفاعلية (ROS)، ويعطل غشاءها الحيوي، وهو أحد أهم أدوات مقاومتها. هذا يجعله خيارا واعدا لعلاج الالتهابات الحادة، خاصة عند المرضى الذين يعانون نقص مناعة.
هل لهذه التقنية إمكانيات أوسع في علاج أمراض أخرى؟
نعم، نعتقد أن هذه النتائج يمكن أن تفتح آفاقًا لعلاجات قائمة على الجسيمات النانوية ضد مسببات الأمراض الأخرى المقاومة للمضادات الحيوية، مما يدعم الجهود العالمية في مكافحة مقاومة المضادات الحيوية.
ما هي توصيات منظمة الصحة العالمية بخصوص هذه المشكلة؟
منظمة الصحة العالمية توصي بتطوير مضادات حيوية جديدة لمكافحة هذه البكتيريا المقاومة، وهذا ما نعمل عليه عبر هذا النوع من الدراسات المبتكرة.
ما الخطوات القادمة لفريقكم بعد هذه الدراسة؟ وهل هناك خطة لتجارب سريرية؟
الخطوة التالية هي إجراء تجارب ما قبل السريرية لتقييم سلامة وفعالية المركب في نماذج حية، وبعدها نأمل أن نبدأ التجارب السريرية بالتعاون مع مستشفيات ومعاهد بحثية، لنتمكن من تقديم علاج فعال للمرضى.

ما أبرز التحديات التي تواجهكم في تطوير هذا النوع من العلاجات النانوية؟
من أكبر التحديات هي التأكد من سلامة استخدام الجسيمات النانوية على المدى الطويل، بالإضافة إلى تحديات التصنيع والتكلفة، ونأمل في التغلب عليها من خلال البحث والتطوير المستمر.
aXA6IDIxNi43My4yMTYuNTYg جزيرة ام اند امز